HIDROCARBONETOS
Como o próprio nome já diz, os hidrocarbonetos são compostos formados apenas por átomos de hidrogênio e carbono. São substâncias apolares e consequentemente não conduzem corrente elétrica, além de serem os compostos mais simples da Química Orgânica.
Como o próprio nome já diz, os hidrocarbonetos são compostos formados apenas por átomos de hidrogênio e carbono. São substâncias apolares e consequentemente não conduzem corrente elétrica, além de serem os compostos mais simples da Química Orgânica.
Sempre ouvimos bastante a respeito dos combustíveis, no Brasil temos na história recente a exploração da camada do pré-sal e esta classe de compostos está muito presente nesse assunto. Os hidrocarbonetos são os principais constituintes do petróleo que é formado a partir da deposição de matéria orgânica no fundo de mares e lagos e da sedimentação desse material sob altas pressões e temperaturas. O petróleo pode ter em sua composição hidrocarbonetos cujas moléculas possuem trinta carbonos ou mais.
Outro fato importante e que envolve estes compostos é a octanagem da gasolina que quanto maior for, maior será a resistência a detonação. O que significa que a gasolina com maior octanagem tende a proporcionar um melhor aproveitamento pelo motor da energia proveniente deste combustível. Quimicamente falando, a cadeia carbônica será maior e consequentemente gerará mais energia ao entrar em combustão.
As principais propriedades físicas desses compostos são:
- Insolubilidade em água e solubilidade em solventes orgânicos apolares;
- Todos os alcanos tem densidade menor que 1,0 g/mL portanto flutuam na água;
- Os alcanos não apresentem cor, odor e sabor;
- Os compostos com até 5 átomos de carbonos estão no estado gasoso à temperatura ambiente;
- Os compostos com de 5 a 17 átomos de carbonos são líquidos à temperatura ambiente;
- Compostos que apresentam mais de 17 átomos de carbonos possuem forma de cera, ou seja, são sólidos.
Questão Enem
1. (Fuvest 2013) O craqueamento catalítico é um processo
utilizado na indústria petroquímica para converter algumas
frações do petróleo que são mais pesadas (isto é,
constituídas por compostos de massa molar elevada) em
frações mais leves, como a gasolina e o GLP, por exemplo.
Nesse processo, algumas ligações químicas nas moléculas
de grande massa molecular são rompidas, sendo geradas
moléculas menores.
A respeito desse processo, foram feitas as seguintes
afirmações:
I. O craqueamento é importante economicamente, pois
converte frações mais pesadas de petróleo em
compostos de grande demanda.
II. O craqueamento libera grande quantidade de energia,
proveniente da ruptura de ligações químicas nas
moléculas de grande massa molecular.
III. A presença de catalisador permite que as
transformações químicas envolvidas no craqueamento
ocorram mais rapidamente.
Está correto o que se afirma em
a) I, apenas.
b) II, apenas.
c) I e III, apenas.
d) II e III, apenas.
e) I, II e III.
RESPOSTA:1: [C]
ÁCOOL
Álcool é toda substância orgânica que contém um ou mais grupos oxidrila ou hidroxila (OH) ligado diretamente à átomos de carbono saturados.
Representa-se, em geral, um monoálcool assim:
Representa-se, em geral, um monoálcool assim:

Onde:
R = radical
OH = oxidrila ou hidroxila
R = radical
OH = oxidrila ou hidroxila
Exemplos:



álcool cíclico álcool aromático
Utilidade
Quando ouvimos falar em álcool, seja na TV, rádio, etc. na verdade estão se referindo a um tipo específico de álcool. Neste caso, é o álcool etílico, também chamado de etanol.

O etanol está presente nas bebidas álcoolicas. É tóxico e age no organismo como depressivo do sistema nervoso.
Possui grande importância na indústria química, na fabricação de perfumes, solventes, combustível.
Possui grande importância na indústria química, na fabricação de perfumes, solventes, combustível.
O álcool metílico é um dos mais perigosos e não deve ser ingerido, pois pode causar cegueira. É chamado também de carbinol e ainda, “álcool de madeira”. Este nome foi dado porque antigamente era obtido a partir do aquecimento da madeira em retortas.
Nomenclatura
De acordo com a IUPAC, os álcoois devem ter a terminação OL, quem vem da palavra álcool. A cadeia principal é aquela que contém o carbono ligado à hidroxila. A numeração é feita a partir da extremidade que contém o grupo OH. O nome do álcool será o do hidrocarboneto correspondente á cadeia principal, porém sem a terminação o. deve ser trocado por OL.
Exemplos:



ciclopentanol álcool benzílico
O álcool utilizado como combustível automotivo (etanol hidratado) deve apresentar uma taxa máxima de água em sua composição para não prejudicar o funcionamento do motor. Uma maneira simples e rápida de estimar a quantidade de etanol em misturas com água é medir a densidade da mistura. O gráfico mostra a variação da densidade da mistura (água e etanol) com a fração percentual da massa de etanol (fe), dada pela expressão
 `
`
em que me e ma são as massas de etanol e de água na mistura, respectivamente, a uma temperatura de 20°C.
 `
`
Suponha que, em inspeção de rotina realizada em determinado posto, tenha-se verificado que 50,0 cm³ de álcool combustível tenham massa igual a 45,0 g. Qual é a fração percentual de etanol nessa mistura?
A) 7%
B) 10%
C) 55%
D) 90%
E) 93%
Resposta: C
CETONA
Cetona é todo composto orgânico que possui o grupo carbonila (C = O) em um carbono secundário da cadeia, ou seja, esse grupo sempre vem entre dois carbonos:
O
||
C — C — C
Grupo funcional das cetonas
||
C — C — C
Grupo funcional das cetonas
As cetonas podem ser classificadas de acordo com a quantidade de carbonilas. Se há apenas um grupo carbonila na cadeia, trata-se de uma monocetona; se há dois grupos,trata-se de uma dicetona; se são três grupos, trata-se de uma tricetona.
Se os dois radicais ligados ao carbono da carbonila são iguais, há uma cetona simétrica; mas se são diferentes, há uma cetona assimétrica.
As cetonas de cadeias menores, com até dez átomos de carbono, apresentam-se no estado líquido e menos densas que a água em condições ambientes. As demais são sólidas.
As cetonas líquidas são parcialmente solúveis em água, e a propanona é totalmente solúvel. Já as cetonas sólidas são insolúveis. A solubilidade das cetonas em água é maior que a dos aldeídos em razão de sua maior polaridade por causa do grupo carbonila, que estabelece ligações de hidrogênio. O grupo carbonila também torna as cetonas muito reativas.
As cetonas menores possuem cheiro agradável e são constituintes de óleos essenciais extraídos de flores e frutos usados na produção de perfumes. Os pontos de fusão e ebulição das cetonas são maiores que os dos aldeídos.As cetonas são muito usadas como matérias-primas na síntese de diversos produtos. São também usadas como solventes de tintas, vernizes, esmaltes, na preparação de sedas e na preparação de medicamentos.
A cetona de maior importância comercial é a propanona, mais conhecida como acetona. Ela é bastante utilizada no dia a dia como solvente de esmaltes de unha. Veja mais sobre ela aqui.
.jpg) A cetona mais usada é a propanona ou acetona
A cetona mais usada é a propanona ou acetona
A nomenclatura desses compostos estabelecida pela IUPAC é feita da seguinte forma:

A produção mundial de alimentos poderia se reduzir a 40% da atual sem a aplicação de controle sobre as pragas agrícolas. Por outro lado, o uso frequente dos agrotóxicos pode causar contaminação em solos, águas superficiais e subterrâneas, atmosfera e alimentos. Os biopesticidas, tais como a piretrina e a coronopilina, têm sido uma alternativa na diminuição dos prejuízos econômicos, sociais e ambientais gerados pelos agrotóxicos.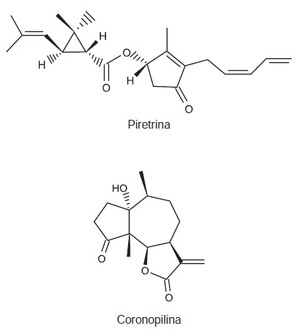

Questão Enem:
Identifique as funções orgânicas presentes simultaneamente nas estruturas dos dois biopesticidas apresentados:
- AÉter e éster.
- BCetona e éster.
- CÁlcool e cetona.
- DAldeído e cetona.
- EÉter e ácido carboxílico.
RESPOSTA CORRETA:
B
Cetona e éster.
O Aldeído mais conhecido é o metanal. Também é chamado de aldeído fórmico ou formaldeído. É um gás incolor, com cheiro muito forte e irritante. Muito solúvel em água. Em geral, é usado como solução aquosa, contendo 40% de aldeído fórmico, e e esta solução é chamado de formol ou formalina. É usado como desinfetante e na medicina, como conservador de cadáveres e peças anatômicas. Usado para a fabricação de medicamentos, plásticos e explosivos. Usado também em produtos de beleza.
O etanal ou aldeído acético ou ainda acetaldeído tem cheiro forte e é solúvel em água. É obtido a partir do acetileno. É o ponto de partida para a fabricação de pesticidas, medicamentos, inseticidas e espelhos. Usado na produção de anidrido acético e ácido acético (presente no vinagre) e resinas.
O etanal ou aldeído acético ou ainda acetaldeído tem cheiro forte e é solúvel em água. É obtido a partir do acetileno. É o ponto de partida para a fabricação de pesticidas, medicamentos, inseticidas e espelhos. Usado na produção de anidrido acético e ácido acético (presente no vinagre) e resinas.
Aldeído é todo composto orgânico que possui o grupo funcional – CHO – ligado à cadeia carbônica.

Exemplos de aldeídos:



(Puccamp-SP) Além de ser utilizada na preparação do formol, a substância da fórmula mostrada na figura a seguir tem aplicação industrial na fabricação de baquelite.
O
//
H — C
\
H
//
H — C
\
H
A função química e o nome oficial desse composto são, respectivamente:
a) aldeído e metanal.
b) éter e metoximetano.
c) ácido carboxílico e metanoico.
d) cetona e metanal.
e) álcool e metanol.
Resposta: A
Ácido Carboxílico
Os ácidos carboxílicos são compostos orgânicos caracterizados pelo grupo carboxila (—COOH), nome e grupo que vem da junção “carbonila (—CO) + hidroxila (OH)”, ou seja, todo ácido carboxílico possui em pelo menos uma das extremidades da cadeia um carbono ligado a um oxigênio e a uma hidroxila, conforme mostrado a seguir:
O
//
— C
\
OH
//
— C
\
OH
Entre os principais compostos da função dos ácidos carboxílicos utilizados no cotidiano, estão o ácido metanoico, mais conhecido como ácido fórmico, e o ácido etanoico ou ácido acético
O ácido fórmico é assim chamado porque foi obtido pela primeira vez através da destilação de formigas vermelhas. Esse ácido é o principal responsável pela dor intensa e coceira sentida na picada desse inseto.

Dentre as aplicações do ácido metanoico, destaca-se seu uso como mordente para ajudar a fixar as cores no tingimento dos tecidos, além de sua aplicação como desinfetante na Medicina.
O ácido acético é o principal constituinte do vinagre, que é usado em temperos na cozinha, em limpezas e na preparação de perfumes, corantes, seda artificial e acetona.
Outra função importante dos ácidos carboxílicos em nossa vida pode ser vista no texto Ácidos carboxílicos e filtros solares.
Visto que os ácidos carboxílicos possuem a hidroxila e o oxigênio, eles realizam ligações de hidrogênio, inclusive realizam o dobro de ligações de hidrogênio que as moléculas dos álcoois. Por esse mesmo motivo, os seus pontos de ebulição e fusão são mais elevados que os dos álcoois.
Vale ressaltar que os ácidos metanoico e etanoico são mais densos que a água. Em relação à solubilidade, os ácidos carboxílicos que apresentam até quatro carbonos são solúveis em água, e os demais são considerados insolúveis.
Questão Enem
Sabões são sais de ácidos carboxílicos de cadeia longa utilizados com a finalidade de facilitar, durante processos de lavagem, a remoção de substâncias de baixa solubilidade em água, por exemplo, óleos e gorduras. A figura a seguir representa a estrutura de uma molécula de sabão.
Em solução, os ânions do sabão podem hidrolisar a água e, desse modo, formar o ácido carboxílico correspondente. Por exemplo, para o estearato de sódio, é estabelecido o seguinte equilíbrio:
Uma vez que o ácido carboxílico formado é pouco solúvel em água e menos eficiente na remoção de gorduras, o pH do meio deve ser controlado de maneira a evitar que o equilíbrio acima seja deslocado para a direita.
Com base nas informações do texto, é correto concluir que os sabões atuam de maneira:
- Amais eficiente em pH básico.
- Bmais eficiente em pH ácido.
- Cmais eficiente em pH neutro.
- Deficiente em qualquer faixa de pH.
- Emais eficiente em pH ácido ou neutro.
RESPOSTA CORRETA:
A
mais eficiente em pH básico

Este comentário foi removido pelo autor.
ResponderExcluir